Le propylparaben, concours kiné AP-HP 2010.
Le propylparaben est un conservateur utilisé dans l'industrie cosmétique pour empécher la prolifération des bactéries. Ce produit est actuellement contesté car il serait cancerigène.
L'écriture topologique du propylparaben ou parahydroxybenzoate de propyle est :
Écrire la formule semi-développée du propylparaben, entourer les groupes caractéristiques et nommer les fonctions correspondantes.
On synthétise au laboratoire cette molécule notée C à partir de deux réactifs notés A et B.
A est l'acide parahydroxybenzoïque.
Quel est le nom du réactif B ? Ecrire sa formule semi-développée.
Le propan-1-ol : HO-CH2-CH2-CH3.
On introduit dans un ballon les quantités de matière n(A) = n(B) = 0,30 mol, quelques gouttes d'acide sulfurique concentré et quelques grains de pierre ponce. On chauffe à reflux le contenu du ballon pendant 45 minutes.
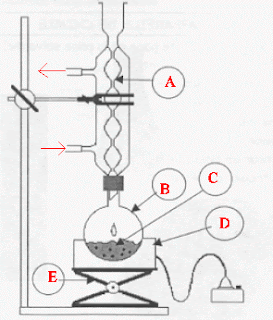
Indiquer la liste du matériel nécessaire pour réaliser le chauffage à reflux
A : réfrigérant à eau ; B : ballon ; C : milieu réactionnel ; D : chauffe ballon ; E : élévateur à croisillons ; support et tuyaux pour l'arrivée et le départ de l'eau.
Le chauffage à reflux permet d'accérer la réaction en travaillant à température modérée, tout en évitant les pertes de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le ballon.
Quel est le nom donné à la transformation chimique réalisée entre les composés A et B ?
Réaction d'estérification entre un acide carboxylique et un alcool.
Pourquoi ajoute t-on de l'acide sulfurique concentré dans le milieu réactionnel ?
La réaction est lente : l'acide sulfurique joue le rôle de catalyseur.
Quel est le rôle des grains de pierre ponce ?
La pierre ponce régularise l'ébullition.
Au bout de 45 minutes, on refroidit le contenu du ballon en y ajoutant une solution aqueuse de chlorure de sodium de masse volumique r = 1,20 g/mL. On verse ensuite la totalité du contenu du ballon dans une ampoule à décanter. On agite l'ampoule et on laisse reposer.
Pourquoi ajoute t-on une solution aqueuse de chlorure de sodium et non de l'eau distillée ?
B et C sont peu solubles dans l'eau et A est très soluble dans l'eau.
L'ester et le propan-1-ol ( n'ayant pas réagi ) sont quasiment insolubles dans l'eau salée.
On peut ainsi isoler le propan-1-ol et l'ester de la phase aqueuse.
Faire un schéma légendé de l'ampoule à décanter en justifiant la position des phases aqueuse et organique.
Masse volumique r(A) = 1,05 g/mL ; r(B) = 1,04 g/mL ; r(C) = 1,06 g/mL.
La phase aqueuse contenant essentiellement de l'eau salée est plus dense que la phase organique conteant le propan-1ol et l'ester C : la phase la plus dense occupe la partie inférieure de l'ampoule à décanter.
Cette synthèse a produit 0,20 mol de composé C.
Calculer le rendement de la synthèse.
Si la réaction était totale on aurait pu obtenir une quantité théorique nth =0,30 mol d'ester à partir de n(A) = n(B) = 0,30 mol.
Rendement : nth / nréel =0,20 / 0,30 = 0,67 ( 67 %).
Comment aurait-on pu augmenter le rendement sans changer la nature des réactifs ?
Ajouter un large excès de l'un des réactifs.
Eliminer l'un des produits au fur et à mesure de sa formation ( distillation du produit le plus volatil ).
Comment peut-on augmenter le rendement en changeant l'un des réactifs ?
Remplacer l'acide carboxylique par le chlorure d'acyle ou l'anhydride d'acide correspondant. Dans ce cas la réaction est totale